Parasites >
Toxoplasma gondii
-
Épidémiologie :
- Parasite intracellulaire
- Répartition : cosmopolite
- Réservoir : Homme et animaux à sang chaud
- Transmission :
- Ingestion d’oocystes : crudités, activités de jardinage, changement de la litière du chat
- Ingestion de kystes : viande crue ou insuffisamment cuite, don d’organes
- Passage transplacentaire des tachyzoïtes : toxoplasmose congénitale
- Séroprévalence mondiale : environ un tiers de la population mondiale séropositive
- En France : disparités régionales de la séroprévalence (plus faible dans les régions montagneuses froides, plus élevée dans le Sud-Ouest), prévalence en diminution
- Facteurs de risque d'infection grave : femme enceinte, immunodépression
-
Morphologie du tachyzoïte :
- Taille : 7 x 4 μm
- Parasite des cellules nucléées de l’organisme
- Responsable des lésions tissulaires
- Multiplication dans les cellules phagocytaires : forme proliférative
- Forme de croissant
- Extrémité antérieure effilée
- Extrémité postérieure arrondie
- Complexe apical : permet la pénétration dans les cellules nucléées
-
Morphologie du bradyzoïte :
- Produit de transformation du tachyzoïte chez l’hôte intermédiaire
- Regroupés au sein de kystes intracellulaires (20 à 100 μm) : cellules musculaires, neurones, astrocytes, cellules rétiniennes
- Métabolisme en quiescence
- Noyau situé à l’extrémité postérieure
-
Cycle évolutif :
- Ingestion d’un hôte intermédiaire hébergeant des kystes dans ses tissus
- Digestion des kystes dans l’estomac du chat : libération des bradyzoïtes
- Pénétration des bradyzoïtes dans les cellules épithéliales du tube digestif puis multiplication
- Transformation de certains bradyzoïtes en gamétocytes puis en gamètes mâles et femelles
- Fusion des gamètes : formation d’un oocyste non sporulé éliminé dans les fèces du chat
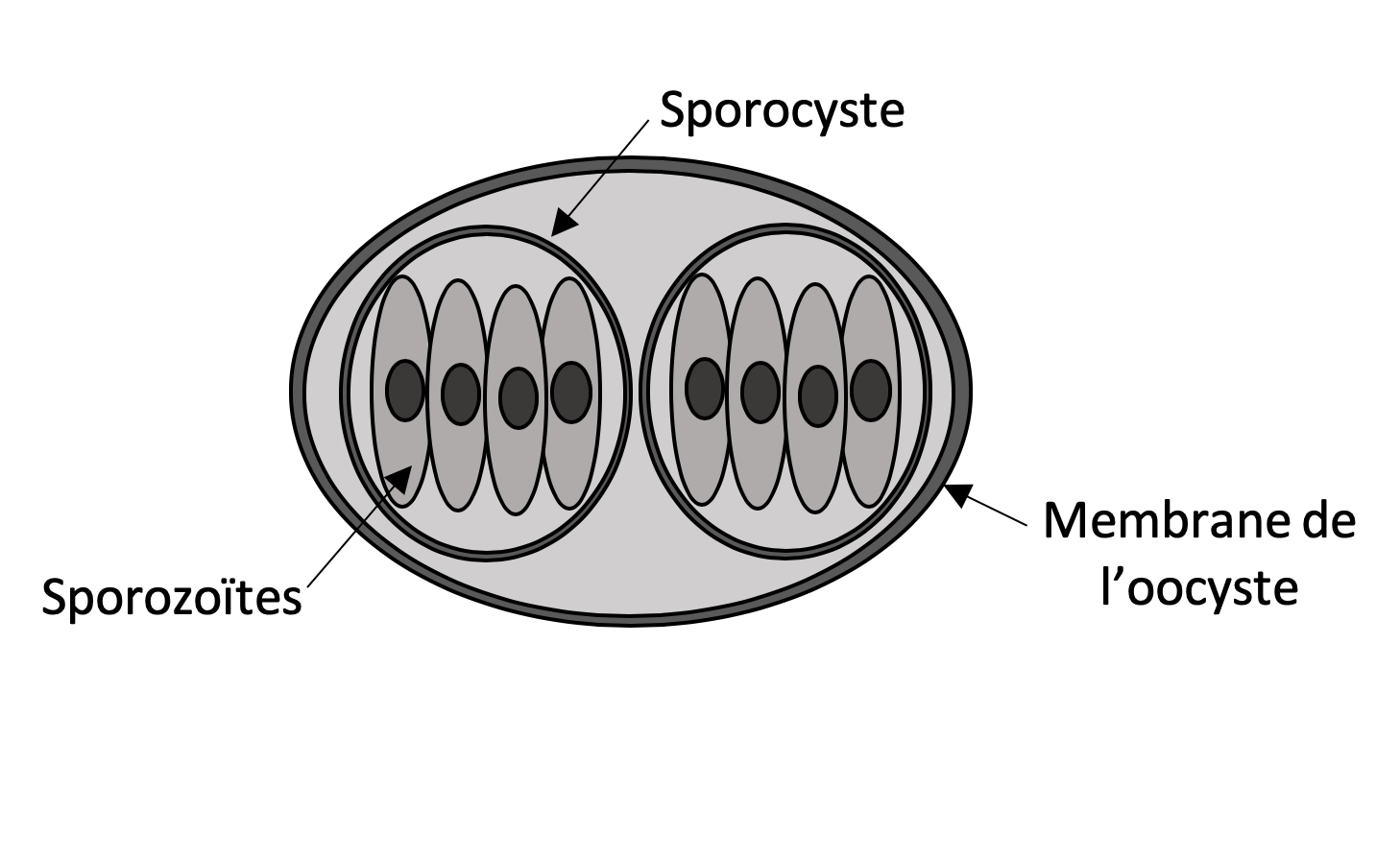
- Sporulation de l’oocyste dans le milieu extérieur (2 à 5 jours)
- Ingestion d’oocystes matures
- Digestion des kystes dans l’estomac : libération des sporozoïtes
- Pénétration des bradyzoïtes dans les cellules épithéliales intestinales
- Transformation des bradyzoïtes en tachyzoïtes
- Multiplication des tachyzoïtes dans les cellules nucléées et dissémination dans l’organisme de l’hôte intermédiaire
- Transformation des tachyzoïtes en bradyzoïtes (ralentissement du métabolisme) au sein de kystes (muscles et système nerveux)
- Transmission des bradyzoïtes contenus dans les kystes entre différents hôtes intermédiaires
- Carnivorisme
- Ingestion d’oocystes ou de kystes
- Libération des tachyzoïtes et diffusion par voie lymphaticosanguine dans tout l’organisme (muscles et cerveau principalement)
- Passage transplacentaire des tachyzoïtes si femme enceinte
- Devenir des tachyzoïtes :
- Enkystement (sujet immunocompétent)
- Multiplication et envahissement des tissus avoisinants (sujet immunodéprimé)
Cycle sexué chez le félidé (hôte définitif) :
Cycle asexué chez l’hôte intermédiaire (herbivores, rongeurs, oiseaux, omnivores) : environ 3 semaines, peut aller jusqu’à plusieurs mois
Cycle incomplet asexué :
Cycle asexué chez l’homme (hôte accidentel) :
-
Diagnostic clinique :
- Agent de la toxoplasmose.
Toxoplasmose acquise du sujet immunocompétent :
- Formes asymptomatiques : 80% des cas
- Formes symptomatiques :
- Syndrome mononucléosique avec hyperthermie, adénopathies et asthénie, évolution spontanément résolutive
- Rétinochoroïdites aiguës (rares, Amérique du Sud)
Toxoplasmose du sujet immunodéprimé :
- Primo-infection ou réactivation d’une toxoplasmose ancienne
- Évolution mortelle sans traitement (sauf formes oculaires isolées)
- Abcès cérébral : céphalées persistantes avec hyperthermie et déficit neurologique (selon la localisation de l’abcès)
- Toxoplasmose oculaire : baisse d’acuité visuelle, rougeur oculaire
- Toxoplasmose pulmonaire : pneumopathie interstitielle fébrile
- Toxoplasmose disséminée : hyperthermie isolée, localisations viscérales secondaires
Toxoplasmose congénitale :
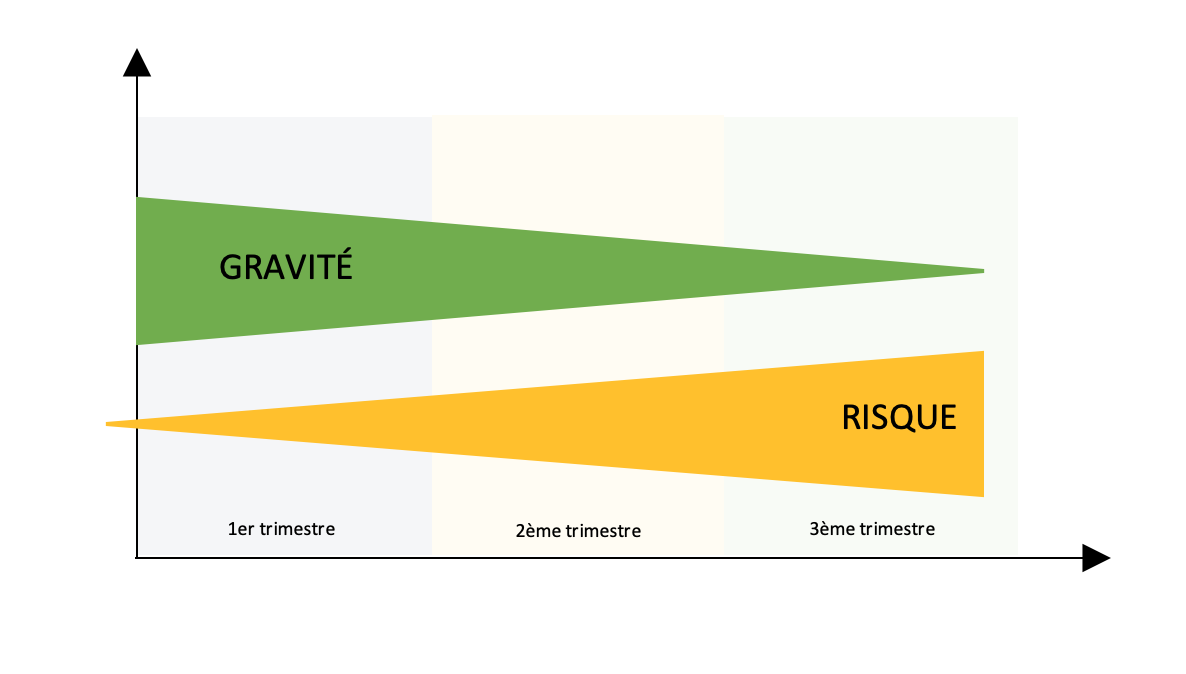
- Risque de transmission augmente avec le terme
- Risque de contamination périconceptionnelle faible (parasitémie persistant plusieurs semaines)
- Gravité de l’atteinte fœtale diminue avec le terme :
- Femme enceinte : avortements spontanés, mort fœtale in utero
- Nouveau-né :
- Toxoplasmose congénitale grave : hydrocéphalie + rétinochoroïdite pigmentaire + calcifications intracrâniennes, encéphalites, formes généralisées (hépatosplénomégalie, anémie, thrombopénie, ictère, purpura, myocardites…), microphtalmies, macrophtalmies
- Toxoplasmose congénitale bénigne : atteinte oculaire ou neurologique atténuée par rapport aux formes graves, hépatomégalie rare
- Toxoplasmose congénitale latente : atteinte oculaire dans l’enfance ou à l’adolescence (nécessite des fonds d’œil réguliers), complications = glaucome, cécité, pathologies vasculaires
-
Prélèvement :
- Sang
- Liquide amniotique (> 16 – 18 semaines de grossesse, 4 semaines post-infection)
- Sang de cordon
- Placenta
- Prélèvements oculaires
- Liquide céphalorachidien
-
Perturbations biologiques :
- Syndrome inflammatoire : augmentation de la CRP
-
Identification :
- Diagnostic sérologique :
- Recherche des IgG et IgM anti-T. gondii (technique immunoenzymatique)
- Si douteux : techniques de confirmation (immunoblot, immunofluorescence, ISAGA)
- Suspicion d’infection aiguë : étude de la cinétique des IgG à 2 à 3 semaines d’intervalle ou test d’avidité des IgG
- Femme enceinte séronégative : suivi sérologique mensuel jusqu’à 1 mois après la fin de la grossesse
- Nouveau-né suspect d’infection maternofoetale : IgM et/ou IgA (entre J0 et J3, à J10, à J15), Blot comparatif mère/enfant, IgG (entre J0 et J3, à J15, à J30 puis une fois par mois)
- PCR sur liquide amniotique, sang de cordon, sang périphérique du nouveau-né, placenta, prélèvement oculaire, liquide céphalorachidien
- Inoculation à la souris : suspicion de souche hypervirulente, conservation des souches
- Pas de culture cellulaire
-
Éléments de traitement :
- Toxoplasmose acquise de l’immunocompétent :
- Habituellement : pas de traitement
- Si symptômes fonctionnels gênants : spiramycine (1 mois)
- Toxoplasmose de l’immunodéprimé ou toxoplasmose oculaire :
- Traitement d’attaque : 3 à 6 semaines
- Traitement d’entretien, durée adaptée au degré d’immunodépression
- 1ère intention : pyriméthamine + sulfadiazine + acide folinique
- Alternative thérapeutique : pyriméthamine + clindamycine
- En cas d'intolérance : atovaquone
- Toxoplasmose congénitale :
- Femme enceinte : spiramycine jusqu’à la fin de la grossesse
- Suivi échographique mensuel
- En cas d'amniocentèse positive :
- Pyriméthamine + sulfadiazine jusqu’à la fin de la grossesse
- Discussion d’une possible interruption médicale de grossesse (si anomalies échographiques)
- Nouveau-né traité pendant un an par pyriméthamine + sulfadiazine + acide folinique
-
Prophylaxie :
- Prévention de la toxoplasmose congénitale et de la toxoplasmose chez l’immunodéprimé :
- Lavage minutieux des crudités
- Cuisson suffisante des aliments
- Lavage minutieux régulier des mains
- Éviter les repas hors du domicile
- Porter des gants lors du changement de litière d’un chat ou de jardinage
- Éviter la consommation de coquillages crus
- Dépistage systématique sérologique de la femme enceinte au cours du 1er trimestre de grossesse
- Dépistage du donneur et du receveur d’organe(s) ou de tissus
- Dépistage systématique sérologique lors d’une découverte de séropositivité pour le VIH
- Chimioprophylaxie primaire (patient VIH +) : cotrimoxazole